01/07/2011
2011, année de la Chimie
 2011 année internationale de la chimie. ARTE en mai, proposait 3 émissions avec pour titre "Les secrets de la matière" liens en fin d'article) pour remonter le temps des pionniers de la Chimie (*).
2011 année internationale de la chimie. ARTE en mai, proposait 3 émissions avec pour titre "Les secrets de la matière" liens en fin d'article) pour remonter le temps des pionniers de la Chimie (*).
Parlons-en de la chimie comme se le propose le CNRS.
Son histoire est très vieille et jeune, à la fois. En fait, de la chimie, on en fait comme Monsieur Jourdain parlait en prose, sans le savoir. Tout ce qui nous entoure, nous même, sont constitués d'éléments chimiques.
Égypte, Chine, Inde, Grèce, Rome ont fait partie de la préhistoire de la Chimie dans l'histoire des éléments chimiques. L'or était la peau des Dieux pour les Égyptiens, la sueur du soleil pour les Incas.
...
Histoire de la Chimie
Les Grecs connaissaient le Plomb (Pb 82), l'Argent (Ag 47), l'Or (Au 79), le Mercure (Hg 80), l'Etain (Sn 50) comme "métaux".
L'alchimie, née à Alexandrie, transite dans les textes arabes, pour être traduite en Europe au Moyen-Age. Convertir le plomb en or avec une pierre philosophale, a toujours été un rêve. Les alchimistes y ajoutent le mystère, le secret dans un langage voulu ésotérique. L'or était un élément spirituel, magique, médicinal. Les métaux trouvent une communion avec les astres (Soleil - l'or, Mercure - le mercure, Vénus - le cuivre, la Lune - l'argent, Mars - le fer, Jupiter - l'étain, Saturne - le plomb).
L'évolution de la science chimique entre en sommeil pendant plus de mille ans jusqu'au début du 18ème siècle.
Georg Bauer dit Agricola, fonde la chimie métallurgique en définissant les alliages de métaux et en écrivant en 1546, "De natura fossilium". Avant cela, on ne connaissait rien du comment le monde est fait si ce n'est que l'eau, l'air, le feu et la terre étaient les éléments constitutifs de l'Univers.
En 1669, Georg Brandt a eu une idée. Comme l'urine est jaune, que le corps humain contient toutes les substances comme un microcosme de l'Univers, il se pourrait qu'il y ai de l'or dans l'urine. Au lieu d'extraire de l'or, c'est du Phosphore (P 15) qu'il obtient. Élément qui fume au contact de l'air mais qui ne brille pas sous les feux de la lumière mais reste visible dans l’obscurité. Il le baptise "Noctiluca", "lumière nocturne". Le feu est considéré comme un principe de la phlogistique qui dit que le bois brûle par la force de la chaleur en dégageant des phlogistons. Ce dérapage de la science va perdurer longtemps.
En 1675, Nicolas Lémery définit dans un traité, les vitriols, les bases et les sels dans une nature divisée entre minéraux, végétaux et animaux.
En 1677, Robert Boyle crée la véritable "science chimique". Avec du Phosphore (P 15) et du Soufre (S 16), il constate pouvoir obtenir le feu sur commande. Les allumettes sont nées t avec elles, la possibilité de reproduire à loisir. Boyle écrit le premier livre de chimie "Le chimiste sceptique" avec, en toile de fond, les réactions rationnelles et scientifiques.
Le riche érudit, Henry Cavendish, trouve un gaz inflammable, explosif, en plongant du zinc dans de l'acide: l'Hydrogène (H 1), Le gaz le plus léger et l'élément le plus abondant dans l'Univers. Composant de l'eau, car, enflammé, il donne de l'humidité. Pourtant il ne s'en rend pas compte.
Pour l'heure, cela fait déjà 19 éléments connus.
Le pasteur Joseph Pristley s'intéresse à un autre gaz, le CO2. Gaz de brasserie, non visible, qui en sortant des cuves prend la tangente en s'affaissant, plus lourd que l'air. En 1774, l'oxyde de Mercure permet de découvrir l'autre atome le plus répandu, l'Oxygène (O 8). Une rencontre de Pristley avec le riche, Antoine Lavoisier va permettre de démystifier cette phlogistique. L'Oxygène, le 3ème élément le plus répandu faisant partie de l'air ambiant, il permet de déphlogistifié les connaissances car l'oxygène de l'air est nécessaire à toutes combustions des matériaux inflammables.
Les gaz, les non métaux, les métaux et les terres qui ne peuvent être décomposés par une réaction chimique sont reconnus comme des éléments.
Désormais, on passe à 33 éléments connus, avec quelques erreurs, mais le progrès est notable par l'approche empirique.
Humphry Davy a l'idée d'introduire l'électricité, en plus du feu, comme outil pour dissocier la potasse. Il découvre le Potassium (K 19), autre explosif. La réaction chimique engendre du Potassium et, en plus, restitue de l'électricité. Le Potassium s'enflamme au contact de l'eau. Un nouveau cap, 55 éléments, connus à sa mort.
John Dalton découvre que les éléments se combinent dans les mêmes proportions avec des atomes différents qui ont tous un poids atomique propre. Peser la matière, c'est Jon Jacob Berzelius qui s'y intéresse.
La triade des éléments de Lithium (Li 3), du Sodium (Na 11), du Potassium (K 19) ont des similitudes en dégageant de l'hydrogène. On leur associe une même famille.
Calizaro essaye de trouver un moyen fiable de percer les secrets des atomes.
En 1796, Smithson Tennant brûle le diamant, que l'on sait contenir du Carbone comme le graphite. Il va comprendre le secret de leurs différences. Les diamants ne sont, de fait, plus éternels!
John Newland associe les éléments par huit comme dans des octaves musicales.
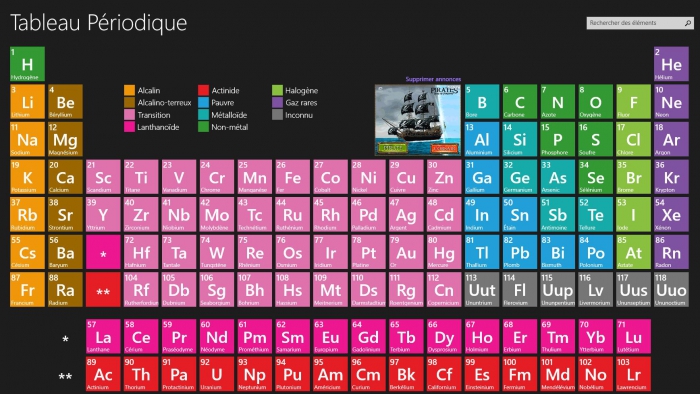
En 1869, Dmitri Mendeleev a l'idée de les réunir poids et propriétés des éléments, par famille, pour les 63 éléments déjà connus dans une table qui porte son nom. Les alcalins à gauche et les halogènes à droite, les métaux au centre.
Si des espaces restent vides, il a confiance de les combler dans l'avenir.
Robert Bunzen et Kirshov remarquent les couleurs uniques de chaque élément sous la flamme.
En 1875, le Gallium (Ga 31) est ainsi découvert par Paul_Emile_Lecoq_de_Boisbaudran.
Qu'est-ce qui rend une réaction lente ou rapide? Pourquoi certains sont volatiles? Les questions restent entières.
En 1909, Ernest Rutherford y répond en donnant la structure de l'atome. Protons dans le noyau et électrons qui gravitent autout de lui.
Niels Bohr perfectionne l'idée et découvre que les électrons gravitent sur des orbites différentes avec un maximum d'électrons qui augmentent, au fur et à mesure de leur éloignement du noyau (2, 8, 18, ...). Les dernières orbites cherchent à rendre l'élément plus stable et tentent ainsi de s'associer. L'union fait la force, en quelques sortes, mais sans exagérer le processus.
Henry Mozeley associe le spectre d'énergie aux éléments. Le nombre de protons donne son numéro atomique, non son poids total, à l'élément de l'Hydrogène à l'Uranium.
L'échantillon complet des éléments naturels de la matière sont au nombre de 92. L'étape suivante est d'en créer, artificiellement à partir d'un existant.
Justus von Lidish et Fredrich Vöeler vont croiser le fer avec leurs expériences.
L'Argent, le Carbone, l'Azote et l'Oxygène réunis ne peuvent qu'être explosifs pour le premier. Pas pour le second. Tous les deux avaient raison. Car, explosifs, ils ne le sont pas toujours. La découverte des isomères va l'expliquer. Les réactions sont dépendantes de la manière dont on assemble les éléments. La valence explique la fusion des atomes. c'est le nombre maximal d'atomes d'un élément univalent avec lesquels un atome de cet élément peut s'associer pour devenir plus stable électriquement.
La valence d'un atome dans le cadre d'une molécule ou d'un ion est le nombre de liaisons covalentes que cet atome a formé. La valence d'un ion monoatomique en solution, est sa charge, on parle alors d'électrovalence. Tout est donc un problème de stabilité recherchée par les atomes par l'intermédiaire de leurs potentiels électriques.
Archibald Scott Couper comprend comment les atomes sont reliés entre eux par des liaisons chimiques en chaînes continues. Dans le même temps, Friedrich Kekulé arrive aux mêmes conclusions et prend de vitesse, son "alter ego" et récolte les honneurs de la découverte. La désillusion de Couper l'entrainera dans la déchéance.
La chimie industrielle est née avec le Carbone (C 6) comme point positif. On l'appelle, chimie organique. Elle s'attache à la tâche de construire des molécules de plus en plus grosses avec du Carbone associé à d'autres atomes.
Les plastics, la bakélite, les fibres en nylon vont révolutionner l'industrie. Wallace Carothers, invente les bas de nylon qui vont faire fureur. Mais il souffre de dépression. Après avoir déposé le brevet du nylon, il se suicide, en avalant du Cyanure de Potassium.
Les chercheurs vont progressivement s'intéresser aux éléments radioactifs. La physique entre en communion avec la chimie.
En 1896, Henri Beckerel découvre la radioactivité naturelle.
Ernest Rutherford remarque que si les atomes changent ses propriétés par désintégration en éjectant des particules nommées alpha. Les atomes ne sont pas immuables comme on le pensait jusque là. Les protons (+), et les électrons (-) qui tournent autour, devient la représentation reconnue. L'identité d'un atome change par ses pertes de particules alpha, par transmutation. La mutation de l’Azote (N 7) en Oxygène se produit par cet intermédiaire.
En 1932, James Chadwick découvre que si les atomes comportent des protons de charge positive, il existe aussi des neutrons qui ne sont pas chargés électriquement dans le noyau de l'atome.
En 1934, Enrico Fermi se rend compte qu'en bombardant les atomes lourds avec des neutrons qui ne génèrent aucune répulsion électrique, il peut créer d'autres éléments plus lourds que l'Uranium (U 92).
En 1938, Otto Hahn, Lise Meitner et Otto Frish parviennent au stade de la fission nucléaire artificielle en créant une énergie colossale par une chaine de réactions instantanées.
Cette découverte intéresse les militaires et nous sommes en temps de guerre. Le projet Manhattan est à l'origine de la bombe. Bombarder un Uranium avec un neutron qui éjecte d'autres neutrons dans une réaction en chaîne. Perte de masse contraire à la loi de Lavoisier mais qui s'explique par la célèbre formule d'Einstein, E=MC2. La masse disparue est transformée en énergie dans une parfaite équivalence.
En 1940, Mc Millan crée l'élément 93, le Neptunium (Np 93).
En 1941, c'est au tour du tristement célèbre Plutonium (Pu 94).
Un des derniers éléments, le 112ème, le Copernicium (Cn 112) est créé à partir de Zinc (Zn 30), lancé sur une cible de Plomb. Dépassé, à son tour, pour arriver, plus récemment, à la synthèse de 3 atomes de Ununoctium (Uuo 118) de l'isotope 294.
Aucun élément chimique de numéro atomique supérieur à 82 (Plomb) ne possède plus d'isotope stable30. Tous les éléments de numéro atomique supérieur à 101 (Mendélévium) ont, en plus, une période radioactive inférieure à la journée.
Le cyclotron, inventé par Ernest Lawrence, en 1931, à Berkeley, est une machine à bombarder la matière pour aller toujours plus loin. Elle atteignait la puissance de 80keV.
Le synchrotron arrive en 1946. Le LHC atteint 35TeV, aujourd'hui et le SV de juillet s'inquiète d'avoir atteint une limite avec lui. Les chances de fusions des atomes encore plus lourds, deviennent pourtant de plus en plus minces. L'instabilité des éléments ne donne plus qu'une durée de vie de quelques secondes. Les nouveaux nés ne sont plus décelés que par leurs traces.
...
Revenir à l'atome d'Hydrogène, le plus simple, le plus abondant, pourrait devenir de plus en plus nécessaire pour recréer l'énergie du Soleil sur Terre. Autre histoire, qui a débuté et qui démontre une difficulté d'une autre ampleur. La nanotechnologie est un autre moyen d'aborder la matière. On en parle, cette fois, du bout des lèvres. J'y reviendrai certainement.
Les éléments, une histoire de familles avec des hauts et des bas, des chaines de gauches et de droites, actives ou radioactives.
 Un vent d'optimisme souffle sur la chimie. L'histoire de l'Univers est en marche. La saga continue, parfois en pénurie de rêves.
Un vent d'optimisme souffle sur la chimie. L'histoire de l'Univers est en marche. La saga continue, parfois en pénurie de rêves.
Je ne sais si vous êtes comme moi, j'aime garder le mystère dans la Science. De voir de la magie, les miracles de la Chimie, avec de nouvelles couleurs éclatantes qui apparaissent en mélangeant les éléments entre eux, c'est ce qui a dû m'attirer dans ma jeunesse.
Je commence à comprendre que les alchimistes effrayaient, tout en gardant une certaine aura parmi les foules. Les chimistes d'aujourd'hui ont perdu cet aspect "merveilleux" du magicien. Voir cette magie, longtemps, et pas uniquement, l'espace de quelques secondes, n'est-ce pas la meilleure manière d'en profiter? Sans ce délais, ça perd un peu de son charme, à mon avis.
Comme le CNRS l'écrivait: "La chimie se trouve tantôt conspuée et rendue responsable de tous les maux, tantôt portée aux nues comme l’alliée bienfaitrice de notre quotidien. Santé, alimentation, loisirs, mais aussi pollution, accidents industriels ou domestiques… Le chimiste n’en est pas moins épargné, qu’il soit chercheur ou industriel. Responsable oui, coupable non, le chimiste, ce véritable artisan de la matière est sans doute le plus interdisciplinaire des scientifiques. Qu’il se pique d’éthique, de philosophie ou de pédagogie, il redoublera toujours d’astuces pour redorer l’image sans cesse écornée de cette discipline séculaire ! Et il le fera d’autant mieux qu’il s’accompagnera de ses collègues scientifiques dans un élan d’interdisciplinarité pour apporter des éléments de réponse aux questionnements sociétaux.
A la base, un savoir faire. Bien sûr.
Qui ou quoi arrêterait le chimiste, sinon l'abandon de poste des éléments?
Je ne parle pas uniquement des éléments de matière, bien entendu.
L'enfoiré,
(*) Les éléments sont cités dans l'article, suivis de leur symbole et de leur numéro atomique.
Citations:
-
« Il est bien difficile de croire que tant de merveilles, tant d'ingéniosité dans le monde soient l'effet du hasard et de la chimie seulement»., René Barjavel
-
« Les merveilleuses découvertes de la chimie sont surpassées peut-être par la confiserie. Jadis toute drogue avait un goût particulier ; aujourd'hui, c'est le contraire. », Alexandre Pothey
2/12/2018: L'hélium, un élément très simple et pourtant un gaz à tout faire: 
31/1/2021: Pasquale Nardone parle des neutrons qui disparaissent en les extrayant de l'atome
Publié dans Actualité, Histoire, Science | Lien permanent | Commentaires (7) |  Imprimer
Imprimer




Commentaires
Écrit par : Victor | 01/07/2011
:-)
Écrit par : L'enfoiré | 01/07/2011
Cela a été fait, j'ai oublié de le mentionner ici
http://vanrinsg.hautetfort.com/archive/2010/12/20/nano-revolution-invisible.html
Écrit par : L'enfoiré | 16/08/2012
Avant dernier, parce qu'il y a encore une place pour le 118ème qui a déjà un nom.
Mais les catégories mises en colonnes risquent de ne plus correspondre.
Un nouveau groupe devrait s'ajouter aux alcalins, alcalino-terreux, non-ferreux, gaz rares, métaux, lanthanides, actinides, halogènes aux 18 colonnes réparties en 7 lignes.
Mais la probabilité est assez basse.
Écrit par : L'enfoiré | 29/07/2014
Dans The Guardian, Mark Lorch a rassemblé cinq découvertes chimiques qui ont changé le monde et la vie des personnes. La chimie a tendance à être négligée par rapport aux autres sciences mais sans elle, nous n’aurions pas accès à de nombreuses choses dont nous disposons aujourd’hui, écrit l’auteur.
1. La pénicilline
La pénicilline a certainement sauvé des vies. Sans elle, une piqûre d’épine ou un mal de gorge serait fatals. En 1928, Alexander Fleming l’a découverte en observant comment des staphylocoques sur ses boîtes de Petri ne poussaient pas grâce à une substance qu’il nommeraplus tard pénicilline. Cette substance avait pu supprimer la croissance des bactéries. Cependant, Fleming n’a pas réussi à extraire une pénicilline qui soit utilisable. En 1939, une pharmacologue australien, Howard Florey, et son équipe de chimistes ont trouvé un moyen de purifier la pénicilline. Mais à cause de la Seconde Guerre mondiale, le matériel scientifique manquait. L’équipe a donc construit une usine de production de pénicilline à l’aide de baignoires, de cartons de laits et d’étagères. La production massive de pénicilline n’a commencé qu’en 1944.
2. Le procédé Haber-Bosch
L’azote joue un rôle essentiel dans la biochimie des êtres vivants. C’est également le gaz le plus courant de notre atmosphère. Toutefois, il ne réagit pas avec beaucoup de choses et les plantes et les animaux ne peuvent pas l’extraire de l’air. Par conséquent, un facteur qui limitait l’agriculture était la disponibilité d’azote. En 1910, les chimistes allemands Fritz Haber et Carl Bosch ont changé la donne lorsqu’ils ont combiné l’azote atmosphérique et l’hydrogène pour le convertir en ammoniac. Ce dernier a pu ensuite être utilisé dans les cultures comme engrais. De nos jours, environ 80% de l’azote de notre corps est issu du procédé Haber-Bosch.
3 Le polyéthylène
Vous l’avez certainement utilisé à un moment donné. La plupart des objets plastiques courants sont des formes de polyéthylène : des conduites d’eau aux emballages alimentaires en passant par les casques. Les 80 millions de tonnes de ce produit fabriquées mondialement chaque année se doivent à des découvertes accidentelles. En 1898, le chimiste allemand Hans von Pechmann, alors qu’il menait des recherches dans un tout autre domaine, a découvert une substance cireuse sur la partie inférieure de ses tubes. Avec ses collègues, ils ont constaté que ce composé chimique était fait de longues chaînes moléculaires qu’ils ont nommées polyméthylène.
En 1933, une méthode totalement différente pour produire du plastique a été découverte par une entreprise chimique. Alors que des scientifiques travaillaient sur des réactions à haute pression, ils ont remarqué la présence de la même substance cireuse. Au début, ils n’ont pas pu reproduire l’effet jusqu’au moment où ils ont remarqué que l’oxygène de la réaction initiale s’était échappé dans le système. Cette découverte fortuite s’est ensuite convertie en méthode pratique pour produire de plastique.
4. La pilule contraceptive et l’igname mexicaine
Dans les années 30, les médecins ont découvert le potentiel des thérapies hormonales pour le traitement des problèmes hormonaux, des troubles menstruels et pour la contraception. Mais la recherche était freinée par la lenteur et l’inefficacité des méthodes de synthèse d'hormones. A cette époque, la progestérone coûtait l’équivalant de 1.000 dollars le gramme. Cependant, Russel Marker, un professeur de chimie organique, a réussi à réduire les coûts de production de la progestérone à l’aide d’un raccourci pour la voie de synthèse. Marker s’est mis à chercher des plantes avec des molécules similaires à la progestérone et a découvert l’igname mexicaine. A partir de ce tubercule, il a isolé un composé en une seule étape afin de convertir la progestérone en pilule contraceptive.
5. Les écrans plats
Les plans pour construire des écrans plats de couleur remontent aux années 60. A l’époque, le ministère de la Défense britannique a décidé qu’il fallait des écrans plats pour remplacer les tubes à rayons cathodiques encombrants et coûteux des véhicules militaires. Une technique à base de cristaux liquides a été choisie. On savait déjà qu’il était possible de fabriquer des écrans à cristaux liquides (LCD) mais le problème était qu’ils ne fonctionnaient qu¿à des températures trop élevées.
En 1970, les autorités britanniques ont demandé à George Gray de l’université de Hull de construire un système pour faire fonctionner les écrans LCD à des températures plus supportables. Gray a découvert une molécule appelée 5CB et les appareils avec écrans LCD à la fin des années 70 en ont été équipés. Aujourd’hui, cette molécule est encore présente dans les montres bon marché et dans les calculatrices. Les dérivés de la molécule 5CB permettent à vos téléphones, vos ordinateurs et vos téléviseurs de fonctionner.
Source: http://www.express.be/articles/?action=view&cat=sciences&item=5-inventions-chimiques-qui-ont-change-le-monde&language=fr&utm_source=newsletter&utm_medium=email&utm_campaign=
Écrit par : L'enfoiré | 10/06/2015
D'où viennent les éléments?
Dans la table de Mendéléev, 92 éléments sont stables, les autres ont été trop lourds pour l'être.
H et He viennent du big bang
Li, Be et Bo du vide interstellaire
C, N, O du coeur des étoiles
Cl, Ca, K de supernovae
Pour Au, Y, Pl, il a fallu un choc gigantesque de 2 étoiles à neutrons
Écrit par : L'enfoiré | 30/09/2015
La table de Mendeleïev, aussi appelée appelée tableau périodique des éléments, possède maintenant 4 éléments supplémentaires, ce qui modifie une des références de base des connaissances scientifiques, et signifie que les manuels scolaires ne sont plus à jour.
Suite à leur découverte par des par des scientifiques de Russie, des Etats-Unis et du Japon, puis à leur valisation par l'Union internationale de chimie pure et appliquée le 30 décembre dernier, les éléments 113, 115, 117 et 118 vont compléter la table.
Ce sont les premiers éléments ajoutés depuis 2011, quand la table avait accueilli les éléments 114 et 116. Toutes les nouvelles admissions ont été forgées par l'homme. Les éléments super-lourds sont créés en faisant s'imbriquer des noyaux plus légers les uns dans les autres. Comme d'autres métaux lourds de la table, ils n'existent que durant une minuscule fraction de seconde, pendant la décomposition radioactive, avant de se décomposer en d'autres éléments.
Ces nouvelles découvertes remplissent les 7 lignes, ou "périodes" de la table. En raison de la façon dont la table périodique est organisée, l'existence et même les propriétés des éléments qui peuvent en compléter certaines parties, peuvent être devinés bien avant d'être effectivement ajoutés.
Les noms et les symboles devront être choisis par l'équipe qui les a découverts en fonction d'un concept mythologique, d'un minéral, d'un lieu ou d'un pays, d'une propriété ou d'un scientifique. Ils sont actuellement temporairement nommés d'après leur nombre : ununtrium/Uut (élément 113), ununpentium/Uup (élément 115), ununseptium/Uus (élément 117) et ununoctium/Uuo (élément 118).
Source: http://www.express.be/articles/?action=view&cat=sciences&item=votre-livre-de-chimie-nest-plus-a-jour-la-table-periodique-de-mendeleiev-vient-dintegrer-4-nouveaux-lments&language=fr&utm_source=newsletter&utm_medium=email&utm_campaign=
Écrit par : L'enfoiré | 05/01/2016
Les commentaires sont fermés.